Добро пожаловать, Антон Владыка!
Вы начали работу над заданиями в 21:15:0 4-5-2010 по московскому времени. На решение десяти заданий второго тура отводится 240 минут (4 часа).
Для каждой из приведенных ниже задач Вы должны привести развернутое решение, набранное в текстовом процессоре Microsoft Word. При необходимости набора формул следует использовать MS Equation, MS Paintbrush, CS ChemOffice. Файл с решениями должен содержать как задания, так и решения. Решения должны однозначным образом указывать на задания, которым они соответствуют. Файл с заданиями и решениями должен быть один и включать в себя ВСЕ решенные задания. С использованием приведенной ниже формы Вы должны отправить его на проверку (имя файла может содержать только буквы ЛАТИНСКОГО алфавита без пробелов и точку). В случае, если загрузить файл не удалось, Вы можете прислать его по email на адрес email@chemport.ru, указав в теле письма имя участника Олимпиады. Такой способ отправки решений может быть реализован только в течение времени выполенения заданий. Участники, приславшие решения с опозданием, автоматически выбывают из участия в конкурсе.
ВНИМАНИЕ: контроль времени выполнения заданий лежит на Вас. Оргкомитет не несет ответственности, если Вы не сможете по какой-то причине отправить результаты до окончания выделенного времени - до 1:15:0 5-5-2010 по московскому времени!
ОТСЧЕТ ВРЕМЕНИ УЖЕ НАЧАЛСЯ!
ЗАДАНИЯ ОЛИМПИАДЫ:
Задание 59
а) Какова энергия взаимодействия между фенильной группой фенилаланина и электрическим дипольным моментом соседней пептидной группы? Примите расстояние между группами 4,0 нм и рассматривайте фенильную группу как молекулу бензола. Дипольный момент пептидной группы μ=1,26 Д, и поляризационный объем бензола α’=1,04·10-29 м3.
б) Рассмотрите лондоновское взаимодействие между фенильными группами двух остатков фенилаланина. Оцените потенциальную энергию взаимодействия между такими кольцами (рассматриваемых как молекулы бензола) на расстоянии 4,0 нм. Для ионизационной энергии используйте значение 5.0 эВ. Приняв, что сила равна отрицательному наклону потенциала, рассчитайте зависимость от расстояния силы, действующей между двумя несвязанными группами атомов, таких как фенильная группа в фенилаланине, в полипептидной цепи, между которыми может осуществляться лондоновское дисперсионное взаимодействие. Каково расстояние, на котором сила взаимодействия двух фенильных групп (рассматриваемых как молекулы бензола) двух остатков фенилаланина равна нулю?
Задание 57
а) Причина токсичности угарного газа заключается в том, что молекула моноокиси углерода прочно связывается с гем-группой белка миоглобина. Оцените частоту колебаний группы CO, связанной с миоглобином (частота свободного колебания молекулы CO составляет 2170 см-1), в предположениях:
1) атом, связянный с гемом, неподвижен;
2) масса белка много больше массы атомов C и O;
3) связывание происходит между атомом углерода (CO) с ионом Fe+2;
4) при образование комплекса CO – белок не меняется силовая постоянная связи CO.
б) Из этих четырех предположений два последних спорны. Предположим, что два первых предположения разумны и в нашем распоряжении есть запас миоглобина, буфер, подходящий для получения взвеси белка, 12C16O, 13C16O, 12C18O, 13C18O и инфракрасный спектрометр. Считая, что изотопное замещение не влияет на силовую постоянную связи CO, опишите серии опытов, позволяющие (1) установить, какой атом - C или O связывается с гемом миоглобина, и (2) определить силовую постоянную связи CO в монооксиде углерода, связанной с миоглобином.
Задание 45
Приведите примеры следующих реакций, расставьте коэффициенты:
- оксид + кислота → соль + вода + неметалл
- соль → неметалл + вода
- соль + вода → металл + неметалл + кислота
- соль → оксид + вода + неметалл
- кислота1 + оксид1 → кислота2 + оксид2
- соль1 + соль2 → соль3 + соль4 + неметалл
- неметалл + кислота → оксид1 + оксид2 + вода
- кислота + оксид → неметалл + вода
- соль + неметалл → соль + вода
- гидроксид1 + вода + неметалл → гидроксид2
Задание 51
Материал для одной из исследовательских работ был приготовлен по следующей методике:
«Водный раствор 2-акриламидо-2-метилпропансульфоновой кислоты (1 моль/л), N,N’-метиленбисакриламида (0.05 моль/л), и персульфата аммония (0.25 вес.%) продували аргоном в течение 30-45 минут, а затем нагрели до 40°С и выдерживали в течение 24 часов при этой температуре. После этого материал отмывали водой в течение 1 недели»
1. Опишите процессы, происходящие при приготовлении материала. Ответ сопроводите, если необходимо, уравнениями реакций. Укажите роль каждого из использованных реагентов.
2. Возможно ли получить аналогичный материал при комнатной температуре? Если да, то как необходимо изменить условия проведения процесса?
3. Приведите структуру полученного продукта. В каком (каких) растворителях он растворяется?
4. Как изменяется равновесная степень набухания полученного материала в воде по мере увеличения концентрации N,N’-метиленбисакриламида в исходной смеси? Дайте ответ в виде схематического графика и поясните ход зависимости на характерных участках.
5. Как изменяется равновесная степень набухания полученного материала в водно-этанольной смеси при увеличении в ней доли этанола? Дайте ответ в виде схематического графика и поясните ход на характерных участках.
6. Как изменяется равновесная степень набухания полученного материала в водно-солевой смеси при увеличении концентрации хлорида натрия в ней? Дайте ответ в виде схематического графика и поясните ход на характерных участках.
7. Как изменяется равновесная степень набухания полученного материала в воде при добавлении твердого гидроксида натрия? Ответ поясните.
В других экспериментах вместо 2-акриламидо-2-метилпропансульфоновой кислоты использовали ее смесь с акриламидом.
8. Как изменяется равновесная степень набухания полученного материала в воде по мере увеличения доли акриламида в исходной смеси? Дайте ответ в виде схематического графика и поясните ход на характерных участках.
Задание 42
Дизайн и синтез дендримеров, содержащих несколько хромофорных групп, активных в окислительно-восстановительных процессах, является важным для разработки новых материалов, обладающих свойствами светоиспускания.
Вопрос 1: Что такое дендримеры?
Группа американских ученых использовала простую последовательность реакций для синтеза ароматического дендримера, способного выступать в роли многоэлектронного донора:
Дополнительно известно следующее: вещество А представляет собой ароматическое соединение, образованное атомами трех элементов (содержание углерода – 64.56%, водорода – 5.42%). Атомы водорода А проявляются в ПМР спектре синглетом со значением химического сдвига 4.45 м.д, в спектрах 13С атомы углерода А также дают синглетный сигнал. Вещество В образовано четырьмя химическими элементами (содержание углерода – 49.53%, водорода – 3.38%), его ПМР спектр приводится ниже:
>
Вещества С и D имеют одинаковый количественный состав (содержание углерода – 74.76%, водорода – 4.8%) и такой же качественный состав, как А. Протонные спектры С и D также выглядят достаточно близко. ПМР спектр соединения С приводится ниже:
>>
Вопрос 2: Определите структурные формулы веществ А – D.
Наиболее интересным свойством полученного дендримера D является то, что он теряет сразу шесть электронов в результате единственного этапа окисления.
Вопрос 3: Чем можно объяснить легкость образования гексазарядного катиона при окислении?
Соли гексазарядного катиона хорошо растворяются в хлороформе, хлористом метилене и других неполярных органических растворителях.
Вопрос 4: Чем объясняется высокая растворимость сильно полярного ионного соединения Kat6+An–6 в неполярных растворителях?
Задание 30
В двухатомной молекуле A2 высшая занятая орбиталь имеет возможную симметрию:
- σg
- σu
- πg
- πu
- δg
- δu
Как изменится равновесное межъядерное расстояние при образовании A2+ для каждого случая? Ответ обоснуйте.
Задание 50
Материал для одной из исследовательских работ был приготовлен по следующей методике:
«Водный раствор 2-акриламидо-2-метилпропансульфоновой кислоты (1 моль/л), N,N’-метиленбисакриламида (0.05 моль/л), и персульфата аммония (0.25 вес.%) продували аргоном в течение 30-45 минут, а затем нагрели до 40°С и выдерживали в течение 24 часов при этой температуре. После этого материал отмывали водой в течение 1 недели»
1. Опишите процессы, происходящие при приготовлении материала. Ответ сопроводите, если необходимо, уравнениями реакций. Укажите роль каждого из использованных реагентов.
2. Возможно ли получить аналогичный материал при комнатной температуре? Если да, то как необходимо изменить условия проведения процесса?
3. Какой материал был в итоге получен? Сделайте предположение о его поведении в контакте с водой, водным раствором гидроксида натрия, водным раствором соляной кислоты.
4. Полученный материал был выдержан в течение суток в контакте с разбавленными водными растворами красителей родамина 6Ж и бриллиантового зеленого (исходная концентрация растворов, а также соотношение объемов фаз раствора и изучаемого материала в обоих случаях равны). В результате часть красителей перешла в фазу изучаемого материала. Остаточная концентрация какого из красителей в водной фазе ниже? Ответ поясните.
Насыщенный красителем образец поместили в воду (С), свежеприготовленный раствор аскорбиновой кислоты (А), раствор аскорбиновой кислоты, выдержанный на воздухе в течение 3 суток (В), и раствор аскорбиновой кислоты, выдержанный при 40°C в течение 2 недель (С). При этом следили за оптической плотностью раствора (длина волны 526.5 нм). Эксперимент проводили пи 45°C. По окончании экспериментов С исследуемый образец оставался неизменным, а в экспериментах А, В в итоге образовался раствор, сильно рассеивающий видимый свет.
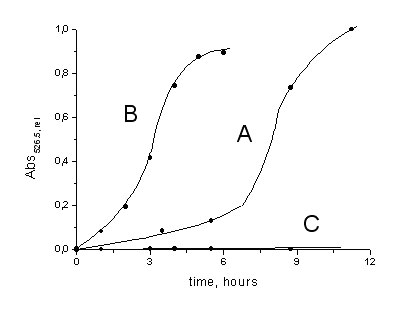
5. Десорбция какого красителя была изучена?
6. Какие превращения претерпевает аскорбиновая кислота в водном растворе в контакте с воздухом? Учтите, что оптическая плотность раствора аскорбиновой кислоты в УФ-диапазоне падает пропорционально логарифму времени наблюдения. Оптическая плотность падает вдвое приблизительно за 70 часов при комнатной температуре.
7. Объясните качественные различия кинетических кривых десорбции А, В, С. Почему не наблюдается различия в кинетике десорбции красителя в воду и в выдержанный длительное время раствор аскорбиновой кислоты?
8. Почему образующийся в экспериментах А, В раствор рассеивает видимый свет?
Задание 46
В аналитическую лабораторию принесли образец крупнокристаллической фиолетовой соли А для установления её состава. Лаборантом были взяты три одинаковые навески А массой 1.000 г. Первую навеску он поместил в фарфоровую чашечку и прокалил в муфельной печи. Масса навески уменьшилась до 0.5671 г, но при длительном стоянии на воздухе вновь стала постепенно увеличиваться. Две другие навески были растворены в 5 мл воды каждая. При добавлении к первому раствору 6.45 мл 5.00% раствора гидроксида калия (плотность 1.044 г/мл) образовался осадок, который полностью растворился в избытке щёлочи. К раствору второй навески химик прилил небольшой избыток раствора хлорида бария. Выпавший белоснежный осадок, нерастворимый в кислотах, он отфильтровал, высушил до постоянной массы и взвесил. Масса осадка составила 0.9339 г. Полученных данных аналитику оказалось достаточно, чтобы определить состав соли. Сможете ли это сделать Вы?
Задание 49
Мономер 2-гидроксиэтилметакрилат (НЕМА) неограниченно смешивается с водой, а соответствующий ему полимер – лишь ограниченно (предельная концентрация полимера в водном растворе перед началом фазового разделения – около 45 вес.%).
1. Укажите причину худшей растворимости полимера в воде по сравнению с мономером.
В таблице ниже приведены составы реакционной смеси при получении нескольких полимерных материалов на основе 2-гидроксиэтилметакрилата.
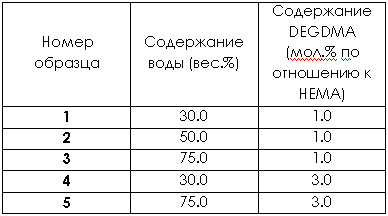
Аббревиатурой DEGDMA закодирован диэтиленгликоль диметакрилат.
Во всех случаях реакцию инициировали введением 0.75 вес.% персульфата аммония и следовых количеств N,N,N’,N’-тетраметилэтилендиамина. В результате реакции образуется полимер, не смешивающийся с водой при любых соотношениях, а лишь ограниченно набухающий в контакте с водной фазой.
2. Приведите название DEGDMA по номенклатуре IUPAC и изобразите его структуру.
3. Запишите схему реакции, протекающей на стадии инициирования полимеризации. Какова функция N,N,N’,N’-тетраметилэтилендиамина в реакционной смеси?
4. Почему образцы 1-5 не образуют гомогенных смесей с водой при любых соотношениях?
5. Сравните между собой равновесное содержание воды в набухшем полимере в образцах 1-3. Ответ мотивируйте.
6. Сравните между собой равновесное содержание воды в набухшем полимере в образцах 1 и 4. Ответ мотивируйте.
7. Сравните между собой равновесное содержание воды в набухшем полимере в образцах 3 и 5. Ответ мотивируйте.
Структура (морфология) образцов 1-3 качественно различна.
8. Какому из образцов соответствует гомогенная (на уровне сотен нанометров) структура образца? Ответ поясните.
9. Какому из образцов соответствует пористая (размер пор до 50 мкм, поры сообщающиеся) структура образца? Ответ поясните.
10. Какой тип структуры можно предположить для оставшегося образца?
11. В каких областях медицины (для создания каких материалов медицинского назначения) могут применяться образцы 1-3?
Задание 58
У молекулы NO существуют возбужденные электронные состояния, достижимые при тепловом возбуждении. У нее есть также неспаренный электрон, поэтому можно ожидать, что эта молекула парамагнитна. Однако ее основное состояние не парамагнитно, поскольку магнитный момент, обусловленный орбитальным движением неспаренного электрона, почти точно компенсирует спиновый магнитный момент. Первое возбужденное состояние (при 121 см-1) парамагнитно, так как орбитальный магнитный момент не только не компенсирует спиновый момент, а складывается с ним. Магнитный момент возбужденного состояния равен 2μB. Поскольку это состояние достижимо при тепловом возбуждении, существует значительная температурная зависимость парамагнитной восприимчивости даже в области комнатных температур. Вычислите мольную парамагнитную восприимчивость NO и опишите ее зависимость от температуры.
